آلزایمر چگونه بر مغز تأثیر می گذارد؟
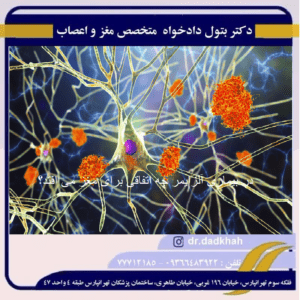
مغز انسان سالم حاوی ده ها میلیارد نورون است که سلول های تخصصی هستند که اطلاعات را از طریق سیگنال های الکتریکی و شیمیایی پردازش و منتقل می کنند. این سلول ها پیام هایی را بین قسمت های مختلف مغز و از مغز به عضلات و اندام های بدن ارسال می کنند. بیماری آلزایمر این ارتباط را مختل می کند و در نتیجه عملکرد مغز را به طور گسترده از دست می دهد زیرا بسیاری از نورون ها به درستی کار نمی کنند و در نهایت می میرند.
اکثر نورون ها دارای سه بخش اصلی هستند:
- بدن سلولی،
- دندریت های متعدد
- آکسون.
بدن سلولی حاوی هسته است، که طرح ژنتیکی را در خود جای داده است که فعالیت های سلول را هدایت و تنظیم می کند. دندریت ها ساختارهای شاخه مانندی هستند که از بدن سلولی گسترش یافته و اطلاعات را از سایر نورون ها جمع آوری می کنند. آکسون ساختاری کابل مانند در انتهای بدنه سلولی در مقابل دندریت ها است که پیام ها را به نورون های دیگر منتقل می کند.
عملکرد و بقای نورون ها به چندین فرآیند بیولوژیکی کلیدی بستگی دارد:
ارتباط. نورون ها دائماً با سلول های مغزی مجاور در تماس هستند. هنگامی که یک نورون سیگنالهایی را از سایر نورونها دریافت میکند، بار الکتریکی تولید میکند که در طول آکسون خود حرکت میکند و مواد شیمیایی انتقالدهنده عصبی را در یک شکاف کوچک به نام سیناپس آزاد میکند. مانند کلیدی که در یک قفل قرار می گیرد، هر مولکول انتقال دهنده عصبی به مکان های گیرنده خاصی در دندریت یک نورون مجاور متصل می شود. این فرآیند سیگنال های شیمیایی یا الکتریکی را تحریک می کند که فعالیت نورون دریافت کننده سیگنال را تحریک یا مهار می کند. ارتباط اغلب در میان شبکه های سلول های مغز رخ می دهد. در واقع، دانشمندان تخمین می زنند که در شبکه ارتباطی مغز، یک نورون ممکن است تا ۷۰۰۰ ارتباط سیناپسی با نورون های دیگر داشته باشد. از دست دادن زودهنگام ارتباطات سیناپسی یکی از علائم اصلی زوال شناختی مرتبط با آلزایمر است.
متابولیسم. متابولیسم – تجزیه مواد شیمیایی و مواد مغذی در یک سلول – برای عملکرد و بقای سلول سالم حیاتی است. برای انجام این عملکرد، سلول ها به انرژی به شکل اکسیژن و گلوکز نیاز دارند که از طریق گردش خون در مغز تامین می شود. مغز یکی از غنی ترین ذخایر خون را در بین هر اندامی دارد و تا ۲۰ درصد انرژی مصرف شده توسط بدن انسان را مصرف می کند – بیش از هر اندام دیگری. در افراد مبتلا به آلزایمر، گلوکز ورودی به مغز کاهش می یابد و همچنین تولید انرژی کاهش می یابد که می تواند نورون ها را به دلیل نیاز به انرژی زیاد تحت تأثیر قرار دهد.
تعمیر، بازسازی و بازسازی. برخلاف بسیاری از سلولهای بدن که عمر نسبتاً کوتاهی دارند، نورونها برای زنده ماندن طولانی مدت تکامل یافتهاند و برخی از آنها در طول زندگی انسان به کار خود ادامه میدهند. در نتیجه، نورون ها باید دائماً خود را حفظ و ترمیم کنند. نورونها همچنین به طور پیوسته اتصالات سیناپسی خود را بسته به میزان تحریکی که از سایر نورونها دریافت میکنند، تنظیم میکنند – یا “بازسازی” میکنند. برای مثال، آنها ممکن است اتصالات سیناپسی را تقویت یا تضعیف کنند، یا حتی اتصالات با یک گروه از نورون ها را از بین ببرند و ارتباطات جدیدی با گروه دیگری ایجاد کنند. مغز بزرگسالان حتی ممکن است نورون های جدیدی تولید کند، فرآیندی که نوروژنز نامیده می شود. بازسازی اتصالات سیناپسی و نوروژنز برای یادگیری، حافظه و احتمالاً ترمیم مغز مهم است. در افراد مبتلا به آلزایمر، شواهدی وجود دارد که حاکی از کاهش نوروژنز در مناطقی از مغز است که در حافظه و یادگیری نقش دارند.
نورون ها بازیگر اصلی سیستم عصبی مرکزی هستند، اما سایر انواع سلول ها نیز کلید عملکرد سالم مغز هستند. در واقع، سلولهای گلیال – انواع سلولهای مغزی که از نورونها پشتیبانی فیزیکی و شیمیایی میکنند – تا حد زیادی پرتعدادترین سلولهای مغز هستند. سلول های گلیال به اشکال مختلفی مانند میکروگلیا، آستروسیت و الیگودندروسیت وجود دارند.
میکروگلیا از نورون ها در برابر آسیب فیزیکی و شیمیایی محافظت می کند و مسئول پاکسازی مواد خارجی و باقی مانده های سلولی از مغز است. آستروسیت ها سلول های گلیال ستاره ای هستند که عملکردهای متابولیکی، ساختاری، تنظیمی و حفاظتی مهمی دارند. الیگودندروسیت ها غلاف میلین را تشکیل می دهند، عایق سلولی محافظ و حمایت کننده در اطراف آکسون ها، که سلول های بلند و باریکی هستند که سیگنال های الکتریکی را به سایر قسمت های بدن ارسال می کنند.
برای انجام این نقش ها، سلول های گلیال با رگ های خونی مغز تعامل دارند. سلول های میکروگلیال و آستروسیت ها نیز در پاسخ ایمنی در مغز نقش دارند. سلولهای گلیال و رگهای خونی با هم تعادل ظریف درون مغز را تنظیم میکنند تا اطمینان حاصل شود که بهترین عملکرد آن را دارد.
تاثیر آلزایمر بر مغز
مغز معمولاً در پیری سالم تا حدودی کوچک میشود، اما در کمال تعجب، سلولهای عصبی را به تعداد زیاد از دست نمیدهد. با این حال، در آلزایمر، آسیب گسترده است، زیرا بسیاری از نورونها به درستی کار نمیکنند، ارتباط خود را با سایر نورونها از دست میدهند و در نهایت میمیرند. آلزایمر فرآیندهای حیاتی برای نورون ها و شبکه های آنها از جمله ارتباطات، متابولیسم و ترمیم را مختل می کند.
در ابتدا، آلزایمر معمولاً به اتصالات بین نورونها در بخشهایی از مغز که درگیر حافظه هستند، از جمله قشر آنتورینال و هیپوکامپ آسیب میزند. بعداً مناطقی در قشر مغز که مسئول زبان، استدلال و رفتار اجتماعی هستند را تحت تأثیر قرار می دهد. در نهایت، بسیاری از نواحی دیگر مغز و نورون های اطراف آسیب دیده و به طور طبیعی کار نمی کنند. با گذشت زمان، فرد مبتلا به آلزایمر به تدریج توانایی زندگی و عملکرد مستقل خود را از دست می دهد. در نهایت این بیماری کشنده است.
ویژگی های اصلی مغز مبتلا به آلزایمر چیست؟
قبل از اوایل دهه ۲۰۰۰، تنها راه مطمئن برای دانستن اینکه آیا فرد مبتلا به آلزایمر است یا نوع دیگری از زوال عقل، مشاهده تغییرات مولکولی و سلولی در بافت مغز زیر میکروسکوپ پس از مرگ بود. به لطف پیشرفتهای تحقیقاتی، تشخیصهایی از جمله تصویربرداری اسکن PET مغز و آزمایشهای خون اکنون در دسترس هستند تا به پزشکان و محققان کمک کنند تا نشانگرهای زیستی مرتبط با زوال عقل را در یک فرد زنده شناسایی کنند و امکان تشخیص دقیقتر و زودتر را فراهم کنند. تحقیقات برای تعیین اینکه کدام تغییرات ممکن است باعث آلزایمر شود و کدام یک نتیجه این بیماری باشد در حال انجام است.
پلاک های آمیلوئید
پروتئین بتا آمیلوئید درگیر در آلزایمر از تجزیه یک پروتئین بزرگتر به نام پیش ساز آمیلوئید تشکیل می شود. این در چندین شکل مولکولی مختلف وجود دارد که بین نورون ها جمع می شود. فرم بتا آمیلوئید ۴۲ به ویژه سمی است. در مغز آلزایمر، سطوح غیرطبیعی این پروتئین طبیعی در کنار هم جمع میشوند و پلاکهایی را تشکیل میدهند که عملکرد سلول را مختل میکنند.
تحقیقات برای درک بهتر نحوه و در چه مرحله ای از بیماری، اشکال مختلف بتا آمیلوئید بر آلزایمر تأثیر می گذارد، در حال پیشرفت است. در ژوئیه ۲۰۲۳، سازمان غذا و داروی ایالات متحده اولین تأیید سنتی خود را از داروی ضد آمیلوئید lecanemab به دلیل پتانسیل آن در کاهش پلاک های آمیلوئید و کند کردن پیشرفت زوال شناختی مرتبط با آلزایمر ارائه کرد. درباره lecanemab و داروهای اضافی و سایر درمانهای آلزایمر بیشتر بدانید.
گره های نوروفیبریلاری
گرههای نوروفیبریلاری تجمع غیرطبیعی پروتئینی به نام تاو هستند که درون نورونها جمع میشوند. نورون های سالم تا حدودی توسط ساختارهایی به نام میکروتوبول ها پشتیبانی می شوند که به هدایت مواد مغذی و مولکول ها از بدن سلولی به آکسون و دندریت کمک می کنند. در نورون های سالم، تاو به طور معمول به میکروتوبول ها متصل می شود و آنها را تثبیت می کند. با این حال، در بیماری آلزایمر، تغییرات شیمیایی غیرطبیعی باعث جدا شدن تاو از میکروتوبولها و چسبیدن به مولکولهای دیگر تاو میشود و رشتههایی را تشکیل میدهند که در نهایت به هم میپیوندند و درون نورونها به هم گره میخورند. این گرهها سیستم انتقال نورون را مسدود میکنند که به ارتباط سیناپسی بین نورونها آسیب میزند.
شواهد در حال ظهور نشان می دهد که تغییرات مغزی مرتبط با آلزایمر ممکن است ناشی از یک تعامل پیچیده بین پروتئین های غیر طبیعی تاو و بتا آمیلوئید و چندین عامل دیگر باشد. به نظر می رسد که تاو غیرطبیعی در نواحی خاصی از مغز که درگیر حافظه هستند تجمع می یابد. بتا آمیلوئید به پلاک های بین نورون ها تبدیل می شود. با رسیدن سطح بتا آمیلوئید به نقطه اوج، انتشار سریع تاو در سراسر مغز وجود دارد.
از دست دادن اتصالات عصبی و اختلال عملکرد سلولی
در آلزایمر، زمانی که نورونها آسیب میبینند و به درستی کار نمیکنند در سراسر مغز، اتصالات بین شبکههای عصبی ممکن است از بین برود و بسیاری از مناطق مغز شروع به کوچک شدن کنند. در مراحل پایانی آلزایمر، این فرآیند – که آتروفی مغز نامیده میشود – گسترده است و در نتیجه مرگ سلولی قابل توجهی ایجاد میشود و باعث کاهش حجم مغز میشود.
التهاب مزمن
تحقیقات نشان می دهد که التهاب مزمن ممکن است در اثر تجمع و ترشحات مضر سلول های گلیال نادرست ایجاد شود. سلول های گلیال سالم به حفظ مغز از مواد زائد کمک می کنند. نوعی سلول گلیال به نام میکروگلیا مواد زائد و سموم را در مغز سالم می بلعد و از بین می برد. هنگامی که میکروگلیا نتواند ضایعات، زباله ها و مجموعه های پروتئینی از جمله پلاک های بتا آمیلوئید را پاک کند، آلزایمر می تواند ایجاد شود. محققان در تلاشند مکانیسم های چگونگی و چرایی اختلال عملکرد میکروگلیا را کشف کنند.
یک مطالعه بر روی پروتئینی به نام TREM2 تمرکز دارد که برای عملکرد مناسب میکروگلیال در طول رویدادهای استرس زا از جمله بیماری های عصبی ضروری است. هنگامی که TREM2 به طور طبیعی عمل نمی کند، پلاک ها بین نورون ها ایجاد می شوند. آستروسیت ها – نوع دیگری از سلول های گلیال – برای کمک به پاکسازی تجمع پلاک ها و سایر سلول های سلولی سیگنال داده می شوند.
زباله میکروگلیاها و آستروسیتهای معیوب پس از آن در اطراف نورونها جمع میشوند اما عملکرد پاکسازی زبالههای خود را انجام نمیدهند. آنها می توانند مواد شیمیایی را آزاد کنند که باعث التهاب مزمن می شوند و به نورون هایی که قرار است از آنها محافظت کنند آسیب بیشتری وارد کنند.
کمک های عروقی به آلزایمر
افراد مبتلا به زوال عقل گاهی به طور همزمان تعدادی از مشکلات عروقی را تجربه می کنند – مشکلاتی که بر عروق خونی تأثیر می گذارد، مانند رسوبات بتا آمیلوئید در شریان های مغز، تصلب شرایین (سخت شدن شریان ها) و سکته های کوچک – ترکیبی که می تواند بر سلامت مغز تأثیر منفی بگذارد. مشکلات قلبی عروقی مانند فشار خون بالا، دیابت و سکته مغزی می تواند به رگ های خونی آسیب برساند و جریان اکسیژن و مواد مغذی را به بافت مغز کاهش دهد و در نتیجه آسیب های مرکب و افزایش خطر اشکال عروقی زوال عقل را افزایش دهد.
مشکلات عروقی ممکن است منجر به کاهش جریان خون و اکسیژن به مغز و همچنین شکسته شدن سد خونی مغزی شود که معمولاً از ورود مواد مضر به مغز جلوگیری میکند و در عین حال گلوکز و سایر مولکولهای لازم را نیز ممکن میسازد. در فرد مبتلا به آلزایمر، اختلال در پروتئین های ناقل تخصصی در سد خونی مغزی ممکن است مانع از رسیدن گلوکز به مغز شود و از پاک شدن پروتئین های سمی بتا آمیلوئید و تاو جلوگیری کند. این منجر به التهاب می شود که ممکن است تغییرات پاتولوژیک در مغز را بیشتر بدتر کند. مطالعات اخیر بر ارتباط بین متابولیسم گلوکز در مغز و جنبههای مختلف آلزایمر، از جمله تفاوتهای جنسیتی در خطر و شدت بیماری تاکید کردهاند. محققان به بررسی مداخلات بالقوه برای برهم زدن این چرخه پیچیده و مخرب ادامه می دهند.